A-Level化学如何才能考到A*?
这是一个十分有深度的问题……
想拿好成绩
除了学科基础知识必须掌握扎实以外
实用的考试技巧也是冲刺高分的不二法宝!
A-Level化学考试做到这几点
A*离你就不远了~
A-Level化学考试技巧
01 使用恰当的科学术语
高分答案往往会在适当的情景中使用准确的科学术语,而得分较低的答案科学语言的使用往往是模糊的、不恰当的。
02 重质量而非数量
为确保有足够的答题空间,考官会计算好每道题的答案行数。正常情况下,试卷所给的答题空间都是充足的,除非划掉不正确的答案,否则不会需要额外的答题纸。
回答解释题的时候要注意逻辑性,把知识点串起来!
03 答案不要前后矛盾
答案如果出现前后矛盾的情况,即使是在附加的答题纸上也会丢分。写错了的答案一定要全部划掉,尤其是使用附加答题纸的时候。
04 仔细读题
仔细阅读问题,注意题目中的指令词,针对指令词和题目背景做出准确回答。
确保你回答的是题目所问的问题,而不是你希望被问到的问题。
05 应用实验知识
把实验操作知识应用到新的环境中去。实验类题目会要求学生把在实验活动中学到的实验知识应用到以前没遇到过的新情况中。
因而这类题目要灵活运用,而不是简单地背诵在课堂上所做的实验。
06 写出做题步骤
写出所有解题的中间步骤,没有解题步骤考官无法给分。多步骤的计算题,垂直向下竖着写解题过程,模糊或者条理不清楚的答案很容易失分。
07 全面回答问题
在答题以前要仔细读题,读两遍,确保自己回答了问题的所有部分。
08 把控好时间
考试时不要着急,答题前多花点时间理解题目中所给数据的性质,避免犯一些马虎错误。
09 保持字迹清晰
考试时注意书写。一定要让考官能够看懂你的答案,否则一定会丢分。
10 难题放到最后
遇到不会的题目,继续往下做,最后再解决难题。
A-Level化学U4
2020年十月考情分析
考试代码及时间:
WCH14/01,2020年10月19日
1.
C。考察follow rate的方法,注意题目说的是不合适的选项。因为反应中H+浓度始终不变所以titration并不合适。
2.
B。考察通过initial rate的方法确定物质的order。对比实验1&2,[Z] x 2,rate x 22,所以Z is 2nd order;对比实验2&3,[Y] x 1/2, rate x (1/2)0, Y is 0 order.
3.
B。考察通过c-t图寻找half-life (time taken for [cis-platin] to half),找图线纵坐标为10所对应的横坐标,读数为460,注意每个小格子对应数值为20min。
4.
a) A。考察rate equation的单位和物质的order。overall order是2,B错;rate可以定义为 △c/ △t,所以单位是 mol dm-3 s-1,C错;[CH3COCH3]是1st order,但I-没有出现在rate equation,[I-]不会影响rate,D错。
b) D。考察rate和rate constant的影响因素,注意题目说的是不正确的选项。rate和rate constant都随T增加而增加,A&B正确;OH-的添加会减少 [H+],[H+]降低会降低反应速率,C正确;D错误。
5.
D。考察rate equation和halogenoalkane 水解 SN1,SN2机理和有机物命名。因为rate equation是unimolecular所以是SN1,所以反应物应该是tertiary halogenoalkane。
6.
B。考察total entropy change表达式。题目已知该反应为exothermic,△H < 0,A错;△Ssurrounding = - △H/ T, △Ssurrounding > 0,B对;反应中 gas produced from solid 所以△Ssystem > 0, C错;△Stotal= △Ssystem+△Ssurrounding,△Ssurrounding和△Ssystem 都> 0, △Stotal > 0,D错。
7.
A。考察平衡常数和反应方程系数的变化关系。Kc表示的方程系数为Kc’的两倍所以Kc= (Kc’)2, 或者分别写出表达式Kc=[H2] [I2]/ [HI]2, Kc’= [H2]1/2 [I2]1/2/ [HI] = Kc1/2
8.
B。考察buffer solution 的pH值计算。pH= pKa+lg[salt]/[acid] = 4.77+(-0.3)= 4.47.
9.
a) D。考察titration curve的形状。题中一个反应物是ethanoic acid,为弱酸,浓度为0.1mol dm-3,所以pH值为2-3之间只有D符合。
b) C。考察end-point的定义,为vertical range的中间点。只有C的中点pH < 7。
c) A。考察indicator的选取,合适的指示剂的pH range 需要完全被包含在vertical range中。
10.
A。考察nucleophilic addition的反应机理。curly arrow需要由nucleophile CN-的lone pair指向带部分正电荷的C,然后由C=O的双键指向带部分负电荷的O。
11.
B。考察iodoform鉴定里有机物的分子方程式。注意ketone和I2在酸性环境下发生iodination,在碱性环境下发生iodoform。
12.
C。考察acyl chloride和amine产生amide的反应方程,和有机物命名。注意题目是不可能产生哪个物质。因为使用的是methylamine所以产物不可能是C。因为会有deprotonation所以会产生HCl,又因为amine有lone pair所以可以和HCl反应生成B。
13.
C。考察percentage by mass的计算。可以先把structural formula转化成molecular formula,A是C2H4O2,B是C3H6O2,C是C4H8O2,D也是C3H6O2。所以排除B,D。A为40%,C为54.5%。
14.
B。考察carbonyl和carboxylic acid的反应。能和Mg发生反应一定是carboxylic acid或者alcohol,但alcohol不可以被LiAlH4还原。
15.
a) C。考察tertiary alcohol和ketone的鉴定。A只对aldehyde有现象,所以不可以区分alcohol和ketone;B可以对primary和secondary alcohol有现象,而题中是tertiary alcohol和ketone所以都没有现象;C可以对aldehyde和ketone的C=O有现象,所以可以区分alcohol和ketone。两个物质都可以溶解于水因为都可以和水形成H键,所以D不可以区分。
b) B。考察tertiary alcohol和primary alcohol的鉴定。所以选B。
c) D。考察tertiary alcohol和aldehyde的鉴定。注意题目问的是不可以区分二者的方式。A对aldehyde有现象,对tertiary alcohol无现象;B对aldehyde有现象,对tertiary alcohol无现象;C对aldehyde有现象,对tertiary alcohol无现象;两个物质都可以溶解于水因为都可以和水形成H键,所以D不可以区分。
16.
a)
ⅰ)
考察Born-Harber圈每一步能量变化的含义
• △H3: Ca(g) + Cl2(g)
• △H4: Ca(g) + 2Cl(g)
• △H5: Ca+(g) + 2Cl(g) + e-
• △H6: Ca2+(g) + 2Cl(g) + 2e-
ⅱ)
考察Born-Harber圈求值,注意Cl的相关项x 2,注意代数时正负号。
• △H1= △H2 + △H3 + △H4 +△H5 + △H6 + △H7
• -795.8 = 178.2 + 2 x 121.7 + 590 + 2nd I.E. + (- 348.8 x 2) + (- 2258)
• 2nd I.E. = 1148.2 kJ mol-1
b) 考察lattice energy理论值和实际值的差别。
• Theoretical value is calculated based on electrostatic model, but CaCl2 has covalent character
• Because Ca2+ has large charge density, hence strong polarising power which could distort Cl-
• So more energy is needed to break the ionic lattice in CaCl2.
c) 注意审题,题目考察的group 2 theoretical lattice energy的变化趋势,这是静电模型得出的值,也就是与离子键强度直接相关。
• Charge of the cation remains the same
• But size of cation increases on descending the group
• So ionic bond is getting weaker, therefore less energy is needed to break the lattice
d) 考察enthalpy change of solution的计算。注意Cl的相关项 x 2。
• △Hsolution= △Hhydration[Ca2+] + 2 x △Hhydration[Cl-] - △Hlattice
• = -1650 + 2 x (-364) - (-2258) = -120 kJ mol-1
17.
a) C5H10O2中C:H比为2,所以一定有双键或环;A, B, C, D都能和Na2CO3反应生成 CO2,所以都是carboxylic acid;A为直链;B在NMR只有两个peak所以只有2种H环境,所以除了-COOH里的H,其他9个H在相同环境,且peak为singlet所以neighbouring C上没有H;C有chiral centre所以branch在2号位;D没有chiral centre所以branch在3号位。
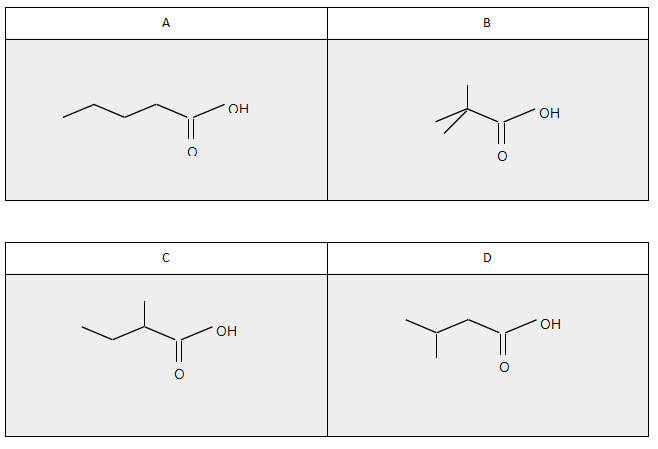
b)
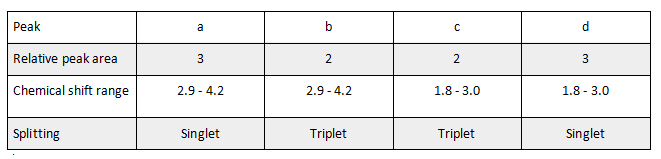
ⅰ) 考察NMR,isomer E有4个H的环境,a环境有3个H,所以b是2,c是2,d是3;a和b都是O-C-H,所以chemical shift相同;c和d都是O=C-C-H,所以chemical shift都是1.8-3.0;b和c的neighbouring C上有2个H,所以都是triplet;d的neighbouring C上没有H,所以是singlet。
ⅱ)
ⅲ) 考察13C NMR,因为E里有5种不同环境的C,所以NMR有
• 5 peaks
d) F是ester,并且由V和W生成;V的IR有 broad adsorption在3050 cm-1,因为carboxylic acid的O-H,同时IR有 adsorption在1720 cm-1,因为carboxylic acid的C=O,所以V是carboxylic acid;因此W必定为alcohol,已知W可以由propanal直接制得,因此W为propanol,F一共有5个C,所以V为ethanoic acid,因此W为propyl ethanoate。
ⅰ) Dd
• V: ethanoic acid, broad adsorption at 3050 cm-1 is due to O-H in carboxylic acid, adsorption at 1720 cm-1 is due to C=O in carboxylic acid. Since W has 3 carbons, V has 2 carbons.
• W: propanol, since V is carboxylic acid, W must be alcohol, as W can be prepared from propanal, W must be propanol.
• F: propyl ethanoate, has pear smell so it is a product of esterification of propanol and ethanoic acid.
ⅱ) 考察aldehyde的还原反应,需要写清reagent和condition。
• LiAlH4 in dry ether
ⅲ) 考察esterification sulfuric acid的作用。
• catalyst
e) 考察boiling point的比较。注意比对的是A (carboxylic acid),E (ether+ketone)和F (ester)
• A has highest boiling point
• Because only A could form hydrogen bond which is the strongest intermolecular force, so more energy is needed to overcome the force.
A, E and F has same number of electrons so similar London force.
18.
a)
ⅰ) 考察pH和Kw相关计算
• [H+] = 10-pH = 10-1.125=7.5 x 10-2 mol dm-3
• [OH-] = Kw / [H+] = 1 x 10-14 / 7.5 x 10-2 = 1.33 x 10-13 mol dm-3
ⅱ) 考察pH相关计算。初始状态pH为1.125,体积为25cm3,可推算nH+ ,因为稀释前后n不变,所以稀释后的体积可由稀释后的[H+] 以及n求得。注意题目要求体积的增加量而不是总体积。
• nH+ when pH = 1.125 is [H+] x V = 7.5 x 10-2 x 25 x 10-3 = 1.875 x 10-3 mol
• [H+] when pH=1.5 is 10-1.5=3.16x10-2 mol dm-3
• V = n / [H+] = 1.875 x 10-3 / 3.16 x 10-2 = 59.3 cm3
• V added is 59.3 - 25 = 34.2 cm3
b)
ⅰ) 考察Brønsted-Lawry acid and base,以及conjugate pair
• Conjugate pair 1: H2PO4-: acid; HPO42-: base
• Conjugate pair 2: H2O: base; H3O+: acid
ⅱ) 考察多元弱酸dissociate第二步很难dissociate的原因
• H+ produced surprise the dissociation of H2PO4-
• pKa of H3PO4 is 2.1, but pKa of H2PO4- is 7.2 so H3PO4 is a stronger acid
c)
ⅰ) 考察Ka的表达式,注意H2O是液体,不需要被写入Ka表达式,另外原方程是H3O+而不是H+
• Ka1 = [ H2PO4-] [H3O+]/ [H3PO4]
ⅱ) 考察pH和Ka1的相关计算
• [H+] = 10-pH = 10-1.2 = 6.3 x 10-2 mol dm-3
• Ka1 = [H2PO4-] [H3O+]/ [H3PO4]
• = [H3O+]2/ [H3PO4] = (6.3 x 10-2) 2/ 0.5 = 7.96 x 10-3
• Unit:mol dm-3
d) 考察buffer solution的工作原理,注意题目只需要分析加入OH-的情况
• H2PO4- and HPO42- are present in large concentration
• When small amount of OH- is added, it deprotonate H2PO4- and form HPO42-,
OH- + H2PO4- —> HPO42- + H2O
• So concentration of [H2PO4-] and [HPO42-] do not change significantly
19.
a)
ⅰ) 考察ΔS⦵system的计算,注意题目提供的是气体的S⦵
• ΔS⦵system = 2 x S⦵[NH3] - S⦵[N2] - 3 x S⦵[H2]
• = 2 x 192.3 - (191.6+ 3 x 130.6) = -198.8 J mol-1K-1
ⅱ) 考察ΔS⦵system 符号的推测
• Yes
• Because 2 mol of gas molecule produced from 4 mole of gas molecule.
ⅲ) 考察ΔS⦵surrounding 的计算,注意温度为700K
• ΔS⦵surrounding = - ΔH/ T
• = -110.2 x 1000/ 700 = 157.4 J mol-1K-1
ⅳ) 考察ΔS⦵total 的计算,注意单位的统一。
• ΔS⦵system = ΔS⦵total - ΔS⦵surrounding = -78.7 - 157.4 = -236.1 J mol-1K-1
ⅴ) 考察温度对速率和反应平衡的影响。题目提示需要从ΔS⦵system 和 ΔS⦵surrounding 的角度分析。注意6分题中6个题目要点都答到得4分,另2分为答题逻辑。
• Advantage: higher T increases rate of reaction
• Because average kinetic energy of molecules increases, so more molecules have energy higher than activation energy
• Disadvantage: higher T decreases yield
• Because for Harber process, ΔH is negative, when T increases, ΔS⦵surrounding becomes less positive
• ΔS⦵total = ΔS⦵system + ΔS⦵surrounding assume ΔS⦵system doesn’t change much, ΔS⦵total becomes less positive
• ΔS⦵total = R ln K, so ln K decreases, therefore K decreases as well which results lower yield
b)
ⅰ) 考察平衡常数Kp,生成物在上,反应物在下,系数变次方。
• Kp = p2NH₃ / pN₂ x p3H₂
ⅱ) 考察平衡常数的计算,已知反应已经在平衡状态下,只需要找出每个气体的partial pressure 带入表达式即可,注意需要标注单位。
• pN2 = 25 atm; pH₂ = 150 atm; pNH₃ = ptotal - (pN₂ + pH₂) = 255 - 25 - 150 = 80 atm
• Kp = p2NH₃ / pN₂ x p3H₂ = (80)2/ (25 x 1503) = 7.59 x 10-5
• Unit: atm-2
ⅲ) 考察压强变化对平衡位置的影响。需要比较Q和K的值。
• When ptotal doubles, partial pressure of each gas doubles,
• Q = 4 x p2NH₃ / 16 pN₂ x p3H₂ = 1/4 Kp
• As Q < Kp, equilibrium shift to left.

A-Level化学U5
2020年十月考情分析
考试代码及时间:
WCH15/01,2020年10月22日
1.
苯的共轭/离域π键delocalised π-bond证明题。与三烯式triene对比无非就是三个方面:
A) Thermodynamics: 加成反应addition reaction放热比三条普通π键更少----一组离域π键比三条普通π键更稳定。(比如此题)
B) IR spectrum:所有六条C-C键键长/吸收光谱皆相同。
C) 二卤代物dihalogeno只有三种isomer而不是四种。
2.
平行的p轨道肩并肩重叠side-way overlap行程离域π键。
3.
Friedel-Crafts acylation FC酰基化反应,反应试剂相应的acyl chloride,催化剂AlCl3。
4.
UV light说明是一个自由基free raidcal反应,既然有甲基methyl说明是一个发生在alkane上的free radical substitution。甲基上的氢被取代。
5.
这个题比较新颖,dinitrophenol苯环上的三取代(两个nitro一个hydroxy)同分异构体isomer判定,其实已然是基于而取代的三种不同isomer来判定的。
具体来说:
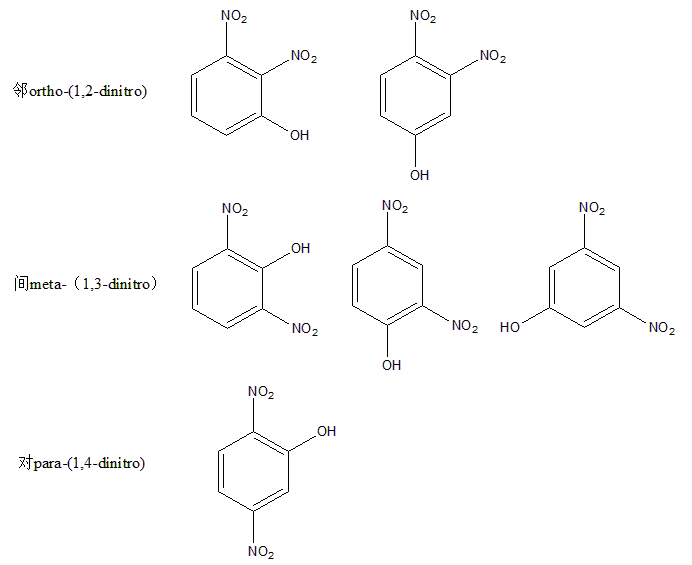
其他结构都与写出的六种重复。
6.
产率yield计算题,比较基础。
根据产物3.67g算出产物数量n=0.26985mol,产率85%,算出理论产物数量n= 0.3174mol也是反应物phenol的数量。所以反应物phenol有2.98g。
7.
经验式类题目。
根据碳元素质量占比91.3%推算出碳氢数量比7.61:8.70。然后分别比较各选项即可,答案是C7H8。因为是选择题所以并不需要硬凑最简整数比。当然因为题目问的是”molecular formula” 所以有可能出现empirical formula没有对应物质的情况,不过这个题没在此设坑。
8.
Amine 与 halogenoalkane亲核取代反应的题目:
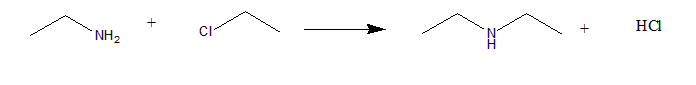
9.
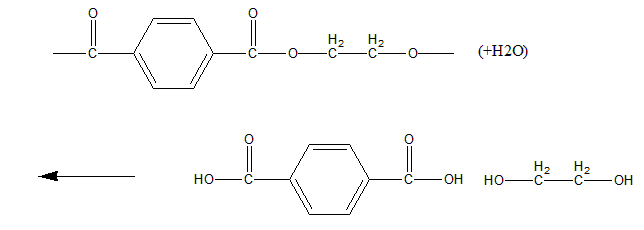
Condensation polymer单体判定,单体分子式按照“酸脱羟基醇脱氢”原则判定即可,需要注意的是structural formula与display/skeletal formula的写法转换。建议看不懂选项时把选项中的结构式改写为display/skeletal formula。
10.
氨基酸amino acid类题目。此处不要求记住氨基酸的名字,只需要能够分辨不同的R基即可。首先需要从酰胺键(肽键)处断成不同的氨基酸单元,然后找到R基。
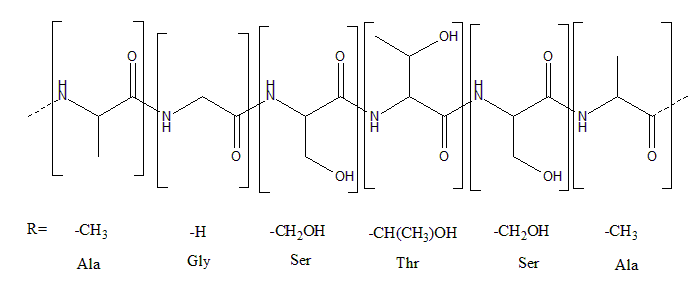
11.
格式试剂题,此处需要牢记格式试剂公式
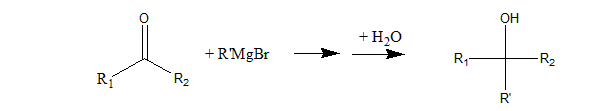
生成secondary alcohol产物意味着R1 R2中应该有一个-H一个alkyl group。所以应该是ethanal。
注意methanal的R1/R2都是H,所以只能生成primary alcohol。
12.
核磁共振-碳谱13C-NMR题,此类题目基本方法就是给碳原子编号,注意对称的碳是同一种。
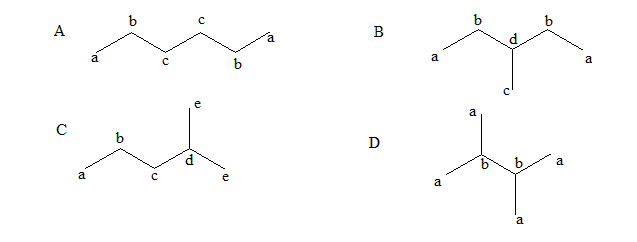
所以只有B选项(3-methylpentane)有四种不同的碳。
13.
茴香酮的分子式,数一数就可以了,比较简单。
14.
Redox(Oxidation number)题。KBrO3中Br是+5,N2O5中N为+5。
15.
Redox题,标定各元素化合价oxidation number就可以了,比较简单。选dichromate + C。
16.
Transition metal题,过渡金属的化合价应为价电子valence electron(3d54s1)全失,所以应该是+6价,比较简单。
17.
NH4+没有孤对电子lone pair,不能作为ligand。此题较简单。
18.
配位数coordinated number为6,数配位键coordinated/dative bond就可以了,比较简单。判定电荷数稍微麻烦一点,需要记住乙二酸根-OOCCOO-是-2价,氯离子是-1价,而题干说了Ni是+2,所以可知总电荷数应为-4。
19.
题干字比较多,但是逻辑其实比较简单。
他说酸性条件下MnO4- → Mn2+ (得到5电子) 消耗体积22cm3.
而中性条件下MnO4- → MnO2 (得到3电子) 所以消耗体积应该是前者的三分之五倍,即36.7cm3。
20.
浓度转换,比较简单,注意每摩尔Cr2(SO4)3中有3mol SO42-。
19.6g dm-3 × 392g mol-1 × 3=0.15mol dm-3
21.
电极电势题。
(a) 盐桥的成分只需不与两个电解质溶液electrolyte中的离子发生反应即可,如KNO3,答案不。
液-液电极要求电极材料化学惰性且导电,Pt和graphite均可。
电解质溶液成分为含有Fe2+和Fe3+的溶液,但此处要求“substance”,故加上阴离子,比如FeCl2和FeCl3。
(b) 给出电池式写半方程和全方程,需注意得失电子,另外反应方向不需要查表, +0.09V的e.m.f说明反应方向应为自左至右,即:
Mn2+ + 4H2O → MnO42- + 8H+ + 5e-
BiO3- + 6H+ +2e- → Bi3+ + 3H2O
2Mn2++8H2O+5BiO3- + 30H+ → 2MnO42- + 16H+ + 5Bi3+ + 15H2O
两边相应物质约掉之后即为:
2Mn2+ + 5BiO3- + 14H+ → 2MnO42- + 5Bi3+ + 7H2O
不约应该不减分。
(c) 能斯特方程题,把相应的量代进去就好了,而且题干明示了n=3,此题较简单。
22.
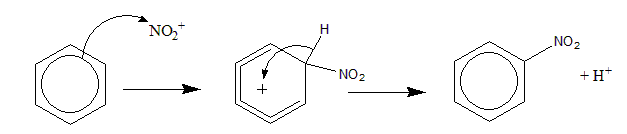
(a) (i) 亲电加成机理改错,比较简单,注意中间体的离域π键位置应在2,3,4,5号碳原子之间。
(ii) 将硝基-NO2还原为胺基-NH2需要Zn + HCl作为还原剂,写Sn + HCl也有分。
(b) (i) 胺基的碱性比较题。因为氮原子上的lone pair会与苯环的delocalise π bond 共轭。三分应该分别来自:① lone pair on nitrogen ②conjugate with (delocalised) π bond of benzene ring ③less likely to donate/accept proton。
(ii) 此处因为只有”few drops” 所以考虑的应该是显碱性从而使得铜离子生成Cu(OH)2 / Cu(OH)2(H2O)4 white precipitate。
(c) (i) benzene diazonium chloride 合成条件应为NaNO2 + HCl / HNO2 , <10°C
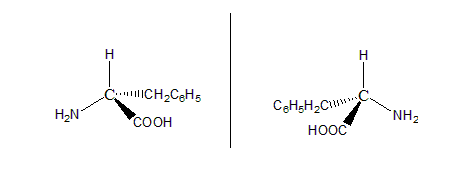
(ii) 将增加的结构写出即可。
(iii) geometric isomer定义题。一方面由于N=N double bond/π bond 存在,另一方面则是two different part on each N。当然此处的two part指的是已经画出的苯环部分,还没有画出的lone pair。此处N应为sp2 hybrid。
(d)比着左边写就可以了,较简单。
23.
(a) Methane 和 ethene混合物在氧气中燃烧,因为体积正比于数量,所以直接将体积代入方程式中运算就可以了,此处需要列二元一次方程组。
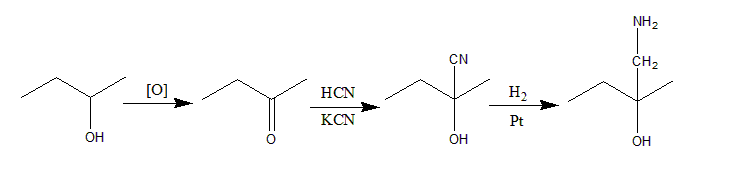
以丁-2-醇 butan-2-ol为原料合成1-胺基-2甲基丁-2-醇1-amino-2-methylbutan-2-ol,此题难度较高,重点在于能否想到增长碳链是如何实现的。增长碳链的方法我们只学过三种,一种是CN-亲核取代,一种是HCN亲电加成,一种是格式试剂Grignard’s reagent与羰基反应。其中亲核取代需要定位在2号位的卤素原子,在2号位本身是-OH的条件下是是非常难以实现的。而剩下的两种方法无论哪种都需要羰基carbonyl group的C=O才能实现,所以步必然是butan-2-ol氧化为butan-2-one。因为产物中有-NH2,很显然选择HCN亲电加成是解。即:
24.
(a) (i) [Fe(H2O)6]3+与NH3反应得到red-brown precipitate必然是Fe(OH)3也就是Fe(OH)3(H2O)3。所以方程式应为:[Fe(H2O)6]3+ + 3NH3 → Fe(OH)3 + 3NH4+ + 3H2O或[Fe(H2O)6]3+ + 3NH3 → Fe(OH)3(H2O)3 + 3NH4+。此反应一般认为是deprotonation。
(ii) ligand exchange,固定答案。
(iii) 经典的二齿配体bi-dent ligand配合物题,答案固定:
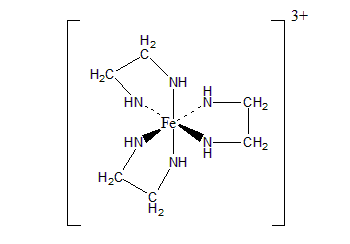
框和电荷可以不写。
(b) (i) 钒vanadium的各化合价离子的颜色记忆规律:“紫绿蓝黄”此处紫色他用了”mauve”木槿紫的说法,我们写的时候大可不必用这么的词。
(ii) VO3- to VO2+ Valency+5 stay constant, so it’s not a redox reaction。
(iii) 电极电势的计算题。选择能够将+2价的钒离子(V2+)依次氧化为+3(V3+)和+4(VO2+)但是不能氧化为+5(VO2+)的氧化剂。
也就意味着需要让钒的还原停留在0.34V~1.00V之间:

电池电动势的计算有两种方式,因为已知的都是各电极/半电池的还原电极电势,所以一种方法是还原电极的还原电极电势减去氧化电极的还原电极电势,这也是课本上介绍的方法,如此题:为保证能够将+2价氧化为+5价,需保证电池电动势Ecell = e.m.f. = Eoxiding agent - Ereducing agent = Eoxiding agent - 0.34V > 0;且Ecell = Eoxiding agent - 1.00V < 0
或者从方程式的叠加上看,氧化半方程+还原半方程=总方程,所以将氧化半方程调换为正确方向,即:
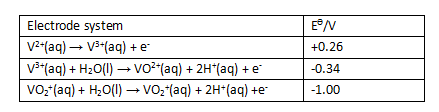
之后再将其与还原半方程相加,计算结果是一样的。
结合氧化半方程的电极电势可知,只有硝酸根还原为二氧化氮NO3- + 2H+ +e- → NO2+H2O的电极电势+0.80V满足+0.34V~+1.00V的要求,即与V2+以及V3+的氧化半方程叠加可以使得电池电动势Ecell = +1.06和+0.46 > 0,反应可以发生;且与VO2+的氧化半方程叠加时电池电动势Ecell=-0.2V<0,反应不可发生。
所以可发生的两个反应方程式和电池电动势分别为:
V2+(aq) + NO3-(aq) + 2H+(aq) → V3+(aq) + NO2(aq) + H2O(l) Ecell = +1.06
V3+(aq) + NO3-(aq) → VO2+(aq) +NO2(aq) Ecell =+0.46
第二个方程式中左右两边的氢离子和水分子不约去一般不减分。
(c) 六分大题,此题属于小拼大的形式。比较过渡金属的均相催化剂homogeneous catalyst和异相催化剂heterogeneous catalyst的催化行为,要求各包括一个例子。
Homogeneous:
① homogeneous catalyst is the catalyst in same phase with reactant
对于均相催化剂来说,此处例子比较好举,可以用课本上铁离子催化过硫酸根persulfate S2O82- 与碘离子反应生成碘单质和硫酸根离子的例子:S2O82- + 2I- → 2SO42- + I2,也可以用铁离子催化双氧水分解等反应作为例子。涉及铁离子(亚铁离子)的反应机理都差不多:
②亚铁离子被氧化剂氧化为铁离子 e.g. 2Fe2+ + S2O82- → 2Fe3+ + 2SO42-
还原剂还原铁离子为亚铁离子 e.g. 2Fe3+ + 2I- → 2Fe2+ + I2
写半方程的话没有先后顺序,重点是催化的机理,即:
③过渡金属得失电子都比较容易/所需能量较少,与氧化剂或还原剂反应速率都较快easy to lose or gain electrons/low energy needed for oxidation number change, fast reaction with both oxidising and reducing agent。
Heterogeneous:
④ heterogeneous catalyst is the catalyst in different phase with reactant
对于异相催化剂来说,例子稍微少一点,课本上的例子是contact process,也就是V2O5催化二氧化硫与氧气反应生成三氧化硫。另外催化转化器catalytic converter(汽车尾气中氮氧化物与一氧化碳的反应),铂催化烯烃加氢等反应也可以,此处没有额外的方程式,但应该需要答异相催化三步骤,也就是表面吸附理论surface absorption theory:
⑤&⑥Absorption: reactant become attach to the surface of the catalyst。
Reaction: weakening of bond in the absorbed reactant。
Desorption: product becomes detached from the surface of the catalyst。
25.
镧系金属的性质,因为”theses elements have some similar properties to d-block element”,所以当做过渡金属即可。
(a) 写下钙还原氟化钬holmium(III) fluoride的反应方程式。
2HoF3 + 3Ca → 3CaCl2 + 2Ho
(b) (i) 为什么钆元素电子构型是[Xe]4f75d16s2而不是[Xe]4f86s2。此处应是由于洪特规则,4f轨道倾向于半满所致,即half-full 4f subshell。
(ii) Sm3+的电子构型,相对于Sm,它会优先失去最外层的6s电子,即:[Xe]4f5。
(c) (i) 为什么铥3+离子Tm3+相比铈3+离子Ce3+更小。因为Tm核电荷数更多,外层电子受到更大引力:Tm has more nuclear charge, outer shell electrons have been attracted closer to nucleus。此处是1单元第二章元素周期律的衍生题。
(ii) 为什么镧系金属的配离子能包含更多的配体。因为镧系金属有更多的价层轨道/f轨道,也就是: use its 4f orbitals in bonding to accommodate more electrons。此处是3周期元素相对2周期元素能容纳多余8电子的题目的衍生题。
(d) 解释一下为什么[La(H2O)9]3+是没有颜色的。过渡金属离子没有颜色的原因无非就3个:①没有配体,不会产生能级分裂no ligands to split (3d) subshells
②(能级分裂的轨道)全空d-orbitals are empty, no electron (in lower energy level) to excited to higher energy level
③(能级分裂的轨道)全满d-orbitals are full, no empty space/orbital (in higher energy level) for electron to excited
此题属于第二种情况,因为La3+电子构型[Xe],价层轨道全空,所以不会有吸收可见光的电子跃迁现象,no visible light will be absorbed for electron excitement。
(e) (i) 求水合硝酸铈铵的经验式和分子式,此种题目和AS中的并无不同。
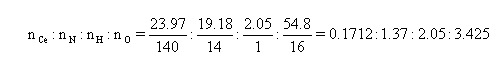
经验式:CeN8H12O20。因为离子化合物的分子式也只能是各离子的最简整数比,所以求分子式可以列三元一次方程组,即设铵根离子NH4+为x,硝酸根离子NO3-为y,H2O为z,则:
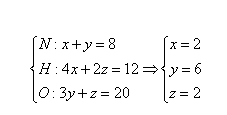
所以分子式为Ce(NH4)2(NO3)6·2H2O
(ii) 已知分子式为C7H16O的有机化合物X不与酸性重铬酸钾溶液反应,但是可以和硝酸铈铵反应生成红色溶液,X有一对光学异构体。推导X的可能结构。
句话分子式符合“CnH2n+2”说明物质饱和无双键,结合“不与酸性重铬酸钾反应”说明X只能是叔醇tertiary alcohol(在不考虑醚的前提下)。第二句话“和硝酸铈铵反应”是一句废话,我们没有学过类似的反应。第三句话“有一对光学异构体”说明要有手性碳原子。叔醇、且有手性碳,首先应该考虑的就是醇的α碳带手性,先画出一个叔醇的基本结构:
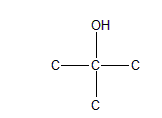
然后再通过加长碳链的方式使三个部分不同,即:
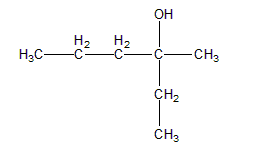
(f) 用铈4+离子Ce4+滴定扑热息痛(对乙酰氨基酚),基本滴定题。
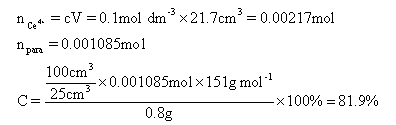
A-Level化学U6
2020年十月考情分析
考试代码及时间:
WCH16/01,2020年10月27日
1.
无机鉴别题,中规中矩。阳离子铜是和阴离子铬酸根都是最经典的过渡元素离子。化合物A是一个绿色固体,包含一个阳离子和一个阴离子,溶于水后形成绿色溶液。加入氢氧化钠NaOH溶液后形成浅蓝色沉淀B和黄色溶液C。
(a) (i) 浅蓝色沉淀B溶于过量氨水中生成深蓝色溶液,包含一个络合离子D。所以此处B必然是氢氧化铜copper(II) hydroxide,Cu(OH)2或Cu(OH)2(H2O)4均可。D则是四氨合铜例子tetrammonia copper(II) ion,[Cu(NH3)4]2+或[Cu(NH3)4(H2O)2]2+均可。
(ii) 当另一份B被加热时,固体变黑。此处生成的应为氧化铜copper oxide CuO。
(iii) 过量的盐酸加入到另一份B中加热,沉淀溶解生成黄色溶液E。此处E显然应该是四氯合铜离子tetrachloro copper(II) ion ]CuCl4]2+,发生了配体交换ligand exchange反应。
(b) 黄色溶液C中加入5毫升稀硫酸,溶液变橙,显然此处说的是铬酸根离子CrO42-到重铬酸根离子Cr2O72-的转换。加入1毫升乙醇缓慢加热,溶液变绿,与醇溶液的氧化反应更加印证了橙色溶液Cr2O72-的身份,生成的绿色必然来自于三价铬离子chromium(III) ion Cr3+。
(i) 黄色溶液为chromate(VI) CrO42-,橙色为dichromate(VI) Cr2O72-,绿色为chromium(III) ion Cr3+。名字与化学式均可。
(ii) 此处乙醇被氧化的有机产物应是乙醛ethanal CH3CHO或乙酸ethanoic acid CH3COOH均可。
(iii) 化合物A应为铬酸铜copper chromate(VI) CuCrO4。
(d) 此处A为绿色的原因显然是阳离子的蓝色与银离子的黄色混合的结果mixture of blue and yellow。这种混色题确实不太常见,但铬酸铜作为1单元中电解证明离子化合物是由阴阳离子组成的实验中就使用过的物质,大家印象应该是有印象的。
2.
有机鉴别题,也非常的规矩。P,Q,R三个有机化合物是分子式C4H8O2的同分异构体。
(a) ①P是无色液体,带有水果味,说明应该是一个酯ester。fruit smell indicate P is an ester.
②当P被与氢氧化钠共热时生成一个挥发性产物,质谱的分子峰在m/z=46,46的峰大家应该比较熟悉了,只有CH3CH2OH+一种组合,说明水解产物为乙醇m/z=46 indicate it’s CH3CH2OH+
③而P中仅有4个碳,所以只能是乙酸乙酯CH3COOCH2CH3。so that P is ethyl ethanoate CH3COOCH2CH3
④P的质谱在m/z=43处有一强峰,印证了乙酸乙酯的猜测,根据“C=O旁边易断开”的原则,m/z=43对应的应是CH3CO+离子m/z=43 is CH3CO+, prove identity of P。
(b)(i) 当Q和R中加入碳酸氢钠溶液时都会产生气泡/泡腾,气体会使澄清石灰水浑浊,非常典型的现象,说明Q和R皆为羧酸。React with NaHCO3 to produce CO2 indicate P and Q are carboxylic acid。有两种可能的结构:
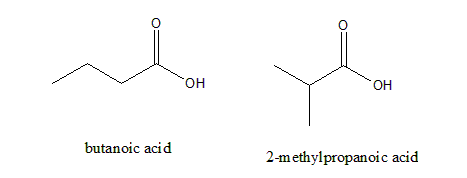
(ii) Q的高分辨核磁共振氢谱如图,引用峰数、相对峰面积和分裂规律来推导Q的身份。其实三个峰已经能够说明应是2-甲基丙酸了,丁酸应有4个峰。
① three peaks indicate three different type of hydrogen.
② relative peak area indicate ratio of hydrogen is 1:1:6
③ splitting pattern of 1:7:2 indicate 1 carboxylic group hydrogen and adjacent hydrogen is 6 and 1 in alkyl part (according to N+1 rules).
④ so Q is 2-methylpropanoic acid
3.
物理化学-反应速率题。测定溴酸根离子和溴离子酸性条件下反应生成溴单质的归中反应速率。
步:在试管中加入10毫升苯酚溶液和几滴甲基橙,溶液变为碱性条件下的黄色。
第二步:继续在其中加入5毫升溴化钾KBr和H2SO4溶液,溶液变为酸性条件下的红色。
第三步:加入15毫升溴酸钾溶液至第二根试管中。
第四步:混合两个溶液并开始计时。
第五步:记录甲基橙被反应生成的过量溴所漂白的时间。
第六步:用不同体积的溴酸钾溶液重复试验,保持溶液总体积为40毫升。
(a) 苯酚有两个危险标志:腐蚀性和有毒。所以除了护目镜和实验服之外还需要手套gloves。此处答通风橱fume cupboard应该也有分。
(b) 解释一下为什么要加苯酚。此处加入苯酚应该是和硫酸形成缓冲溶液,防止酸性过强使得溴离子与硫酸发生氧化还原反应。Act as a buffer. Avoid redox reaction between sulfuric acid and bromide ion。
(c) 建议一个使得甲基橙变色更易观察的方法。此处应该放一张白纸在试管后作为背景。Place a white paper behind test tube。
(d) (i) 为什么溶液总体积恒定。因为此时溴酸根的体积就与混合溶液中溴酸根的浓度呈正比了。Volume of bromate ion will directly proportional to concentration in the mixture。
(ii) 描点画图,注意横纵坐标标注。
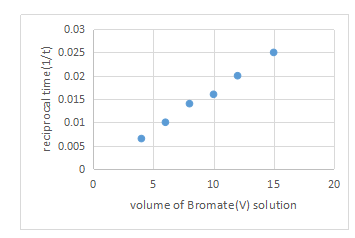
(iii) 相对于溴酸根离子的反应级数。此处时间的倒数是正比于反应速率的,一般我们就将其视为反应速率,而横坐标又与溴酸根离子的浓度正比,所以这其实是一个c-t图像,说明是一级反应。First order due to rate directly proportional to concentration。
(ⅳ)使用时间的倒数作为反应速率的假设,那当然是反应物浓度的该变量恒定ΔC is constant。
(v)另一个学生在实验4中错误的量取了8.5毫升而不是8毫升的溴酸钾溶液,此溶液是否应该弃掉。此处应该是都可以,选弃掉的话:the solution should be discard,since total volume will not be 30cm3/concentration of KBrO3 will not proportional to volume。选不弃掉的话则是:no need to be discarded, 0.5cm3 lesser/6.5cm3 of water should be added so the point can also consist with the line。
(e) 此实验中所有体积量度皆使用50毫升滴定管。
(i) 为什么溴酸钾溶液在一开始会放到另一个试管里而不是直接加到反应混合物中。此处应为方便记录开始时间easy to measure the starting time。
(ii) 给出两个原因为什么实验1的不确定度最小。不确定度受到仪器和度量量的双重影响,应从测量本身和测量次数两方面作答:(Run 1)using largest volume of KBrO3 solution, lowest percentage uncertainty;no need to add additional water, so less uncertainty applied to the measurement。
(f) 为了得到总反应速率方程需要对实验过程做怎样的改动。当然是还需要测量出硫酸/氢离子和溴离子的反应级数: measure rate at different volume of sulfuric acid and bromide ion, while keeping volume of bromate ion constant。
4.
有机操作题:水杨酸(2-羟基苯甲酸)的乙酰化,阿司匹林合成的最后一步。
操作步骤:
步:称取2克2-羟基苯甲酸置于梨形瓶中,夹持(于铁架台上)并冷水浴。
第二步:加入5毫升乙酸酐,加五滴浓硫酸,加入沸石且架设冷凝管准备回流。
第三步:使用本生灯加热水浴,轻搅混合物至固体溶解。
第四步:持续加热10分钟。
第五步:撤掉热水浴,加入10立方公分的碎冰和一些蒸馏水。
第六步:冰水浴烧瓶至没有更多的阿司匹林晶体生成。
第七步:使用布氏漏斗和抽滤装置过滤得到阿司匹林晶体。
第八步:使用乙醇和水重结晶阿司匹林晶体。
(a) 为什么步要冰水浴。因为第二步会放热,addition of ethanoic anhydride/H2SO4 is exothermic。
(b) 第二步加浓硫酸的目的。应该是提供酸性环境/催化剂provide acidic condition/catalyst。
通过计算证明乙酸酐是过量的。
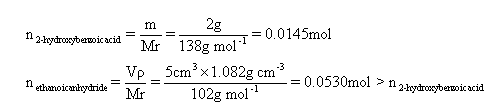
(d) 一个学生画出了第四步中的(回流)装置图,找出三处错误(夹持器具没有问题)。三处错误中最明显的一处应是冷却水流方向:cooling water should enter at bottom and exit at top。第二处错误应是容器选的不对:the flask should be pear-shaped rather than conical。第三处只能说他冷凝管顶部封死了,此处不确定the top of condenser should not be sealed。
(e) 建议为什么要在第五步中加入碎冰和蒸馏水。一方面是溶解硫酸减少其在产物晶体中的量dissolve H2SO4 to remove from product crystal;另一方面是降温使得阿司匹林结晶cooling down to crystalise the aspirin。
(f) 陈述抽滤相对于重力过滤的好处。最简单的就是快faster;其次就是滤液抽取比较彻底remove the filtrate completely;其实还有一点就是抽滤可以进行冲洗操作can be rinsed by solvent,不过这个地方没体现出来。
(g) 测试晶体的纯度。最简单直白的方法就是测熔点了:measure melting point of the crystal; the melting point will be exactly at 136°C if it’s pure。